Кинетика химических реакций и химическое равновесие
Скорость химических реакций.Область химии, которая изучает скорость химических реакций и влияние на нее различных факторов, а также механизмы реакций, называется химической кинетикой.
Чаще всего уравнение химической реакции не отражает реальной последовательности превращений, происходящих с исходными веществами. Такие превращения могут протекать в несколько стадий, каждая из которых характеризуется своим уравнением и имеет свою скорость. Суммарная скорость реакции определяется скоростью наиболее медленной ее стадии.
Различают гомогенные и гетерогенные реакции. Гетерогенные реакции протекают на границе раздела фаз, например твердой и жидкой, твердой и газообразной. Гомогенной называется реакция, протекающая в однородной среде (в одной фазе).
Скорость реакции любого процесса определяется по тем изменениям, которые происходят за определенный промежуток времени.
Скорость гомогенной химической реакции выражают как изменение концентрации исходных веществ (реагентов) или продуктов реакции в единицу времени:
V= ± (C2-C1) / (t2-t1) = ± ΔC/Δt , (2)
где С1 и С2 - молярные концентрации веществ в моменты времени t1 и t2 соответственно; (знак (+) – если скорость определяется по продукту реакции, знак (–) – по исходному веществу.
Очевидно, что в ходе реакции концентрации исходных веществ уменьшаются, а концентрации продуктов реакции увеличиваются
Для того, чтобы выражение для скорости было всегда положительным, при измерении убывающей концентрации исходного вещества перед дробью в выражении (2) пишут знак (-).
Со временем концентрация исходных веществ убывает, поэтому скорость прямой реакции уменьшается и, наоборот, возрастают концентрация продуктов и скорость обратной реакции.
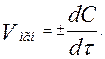 |
Таким образом, скорость химической реакции зависит от концентрации реагирующих веществ и ее следует относить к какому-то определенному промежутку времени. Отметим, что она измеряется по изменению концентрации любого из реагентов или продуктов, но численное значение скорости зависит от этого выбора.
Поскольку скорость со временем меняется, введено понятие мгновенной скорости, которая определяется как производная от концентрации по времени:
Ее можно определить графически по углу наклона касательной к кривой изменения концентрации со временем.
На скорость реакции влияют многие факторы: концентрация реагентов температура, катализаторы, внешние воздействия, например, излучения, пластическая деформация.
Зависимость скорости реакции от концентрации реагентов. Необходимым условием химического взаимодействия различных веществ является столкновение молекул. Повышение концентрации реагирующих веществ увеличивает вероятность столкновения их молекул, тем самым увеличивая скорость химической реакции. Не всякое столкновение приводит к химическому взаимодействию, то есть является эффективным. Повышение давления (для газообразных участников реакции) приводит к сжатию, а, следовательно, и к увеличению плотности вещества. Это эквивалентно
Однако в большинстве случаев реакции многостадийны. Для многостадийных реакций порядки повышению концентрации веществ в единице объема. Поэтому обычно с возрастанием давления скорость химической реакции тоже становится больше.
Экспериментально установлена зависимость скорости реакции от концентрации, которая выражается законом действия масс (К. Гульдберг, П. Вааге). Например, для простой реакции:
аA + вB = сС +дД
скорость реакции пропорциональна произведению концентраций реагирующих веществ ''A'' и ''B'', возведенных в степени ''а'' и ''в'', которые называют порядками реакции по веществу А и В:
V = k [A]а[B]в, (3)
где: [A] и [B] — концентрации реагирующих веществ (квадратные скобки обозначают концентрации); а и в — частные порядки реакции соответственно по веществу А и В; сумма показателей степеней а и в называется общим порядком реакции; k — коэффициент пропорциональности, который называется константой скорости реакции.
Константа скорости реакции зависит от природы реагирующих веществ и от температуры, но не зависит от концентрации реагирующих веществ. Она численно равна самой скорости реакции при условии, когда концентрации реагирующих веществ равны единице.
Если реакция простая, т.е. протекает в одну стадию, то общий порядок реакции равен сумме стехиометрических коэффициентов. Стехиометрические коэффициенты – это коэффициенты перед формулами веществ в уравнении реакции. В этом случае общий порядок реакции совпадает с ее молекулярностью.
Молекулярность не может быть больше 3, так как вероятность эффективного одновременного соударения трех различных молекул, способных образовать соединение, очень мала, а четырех - практически равна нулю.
Порядок реакции по реагентам, как правило, не совпадают со стехиометрическими коэффициентами, а общий порядок реакции не равен сумме стехиометрических коэффициентов. Наиболее часто встречаются реакции первого, второго, иногда – третьего порядков. Некоторые реакции имеют дробный порядок, например, 0,5 и 1,5. Реакции более высокого порядка, чем третий, неизвестны.
Зависимость скорости реакции от температуры. Повышение температуры ускоряет большинство химических реакций. Количественно зависимость скорости реакции от температуры можно описать приближенным правилом Вант-Гоффа:
при повышении температуры на 10 о С скорость многих реакций возрастает в 2-4 раза:
При увеличении температуры от t1 до t2 изменение скорости реакции можно рассчитать по формуле: Vt2/Vt1 = γ (t2-t1)/10
где, Vt2 и Vt1 - скорости реакции при температурах t2 и t1 соответственно; g- температурный коэффициент данной реакции, имеющий значение 2-4.
Правило Вант-Гоффа применимо только в узком интервале температур.
Существует более строгая зависимость скорости реакции от температуры, установленная в 1889г. шведским ученым С. Аррениусом. По Аррениусу влияние температуры сводится главным образом к увеличению числа эффективных соударений, доля которых изменяется с температурой по экспоненциальному закону. Поэтому зависимость скорости химической реакции от температуры определяется температурной зависимостью константы скорости реакции:
kt = k0 • e -∆Е/RT,
где, k – константа скорости реакции; k0 - постоянная, зависящая от природы реагирующих веществ; R - универсальная газовая постоянная [8,314 Дж/(моль•К) = 0,082 л • атм/(моль•К)]; Ea - энергия активации, т.е. энергия, которой должны обладать сталкивающиеся молекулы, чтобы столкновение привело к химическому превращению.
Так как константа скорости входит в выражение скорости реакции, то уравнение Аррениуса можно представить в виде выражения:
Vt = V0 • e –Е а/RT.
где R - универсальная газовая постоянная; V0 - константа пропорциональности, не зависящая от температуры; Т - абсолютная температура; Е - энергия активации, Дж/моль.
Энергия активации Еа - это та, которую необходимо сообщить молекуле, чтобы сделать ее активной. Она зависит от природы реагирующих веществ и является характеристикой любой реакции. Чем больше энергия активации Ea, тем сильнее возрастает скорость реакции при увеличении температуры. Энергия активации зависит от природы реагирующих веществ и катализатора. Энергия активации каталитической реакции ниже, чем энергия некаталитической реакции.
Энергия активации не совпадает с тепловым эффектом химической реакции ∆Н и от него не зависит. Она обусловлена энергетическим барьером, который следует преодолеть сталкивающимся молекулам прежде, чем произойдет перераспределение связей. Этот барьер возникает из-за электростатического отталкивания электронных оболочек реагирующих молекул.
Энергия активации измеряется в системе СИ (кДж/моль). Для разных химических реакций она различна по величине и может изменяться от 5 до 500 кДж/моль. Чем выше энергия активации, тем труднее «заставить идти» эту реакцию.
Необходимо подчеркнуть, что активация молекул может быть достигнута подводом не только тепла, но и других видов энергии: лучистой, электрической, энергии радиоактивных частиц.
Зависимость скорости реакции от агрегатного состояния. Рассматривая кинетику химических реакций, следует иметь в виду, что характер взаимодействия зависит от агрегатного состояния реагентов и продуктов; взятые вместе они образуют физико-химическую систему. Если эта система однородна, в ней отсутствуют поверхности раздела (смесь газов, растворы жидких компонентов и т.д.), то она называется гомогенной. Если же в системе имеются поверхности раздела (например, газ - жидкость, газ - твердое), отделяющие реагирующие вещества, то такую систему называют гетерогенной (разнородной).
Концентрация реагирующих веществ и температура влияют на скорость гомогенной химической реакции. Наличие поверхностей раздела в гетерогенной среде приводит к тому, что химическая реакция будет происходить на поверхности раздела. Как правило, именно эти стадии реакции являются лимитирующими — наиболее медленными стадиями реакции.
Очевидно, что с повышением площади соприкосновения реагентов, при прочих одинаковых условиях, скорость поверхностных реакций будет возрастать.
Очевидно, что с увеличением площади соприкосновения реагентов, при прочих одинаковых условиях, скорость поверхностных реакций будет возрастать.
Химическое равновесие.Многие химические реакции не протекают до конца, другими словами, смесь реагентов не полностью превращается в продукты. По прошествии некоторого времени изменение их концентрации прекращается. Реакционная система в таком состоянии представляет собой смесь реагентов и продуктов реакции. Химическая система в таких условиях находится в состоянии так называемого химического равновесия. Это состояние является динамическим. Под химическим равновесием понимают состояние, когда скорости прямой и обратной реакции равны между собой.
Константа равновесия. Для обратимой реакции, достигшей состояния равновесия, можно применить закон действия масс:
aA + dB D cC + dD
скорость прямой реакции Vпр. = k1 [A]a [B]b равна скорости обратной реакции Vобр. = k2 [С]с [D]d, т.е. Vпр. = Vобр.. Отсюда, k1 [A]a [B]b = k2 [С]с [D]d, а отношение констант скоростей прямой (k1) и обратной (k2) реакций называется константой равновесия Кс:
Кс =  =
= 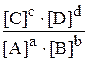 . (4)
. (4)
Константа равновесия равна отношению произведения равновесных концентраций продуктов реакции в степенях, равных стехиометрическим коэффициентам, к произведению равновесных концентраций исходных веществ в степенях, равных стехиометрическим коэффициентам.
Концентрация твердой фазы не входит в (4) выражение, так как она остается постоянной по сравнению с концентрациями газообразной и жидкой фаз.
Для газообразных участников реакции выражение константы равновесия можно записать через парциальные давления.
Константа равновесия зависит от температуры и природы реагирующих веществ и не зависит от их концентрации. Константа равновесия является количественной характеристикой процесса равновесия химической реакции.
Принцип Ле Шателье. Переход системы из одного равновесного состояния в другое называется смещением химического равновесия. Оно подчиняется принципу Ле Шателье:
Если изменить одно из условий, при которых система находится в состоянии химического равновесия (концентрацию, температуру, давление), то в системе протекают процессы, ослабляющие произведенное изменение.
В системе, находящейся в состоянии динамического равновесия, прямой и обратный процессы протекают с одинаковыми скоростями. Изменение условий, в которых она находится, может нарушить состояние равновесия. В результате этого оно смещается до тех пор, пока не установится новое. Принцип Ле Шателье указывает, что смещение равновесия должно происходить в таком направлении, чтобы свести его к минимуму или уменьшить влияние воздействия, вызвавшего нарушение равновесия.
Практическое применение принципа Ле Шателье позволяет предсказать смещение химического равновесия в результате воздействия различных факторов.
1) Изменение концентраций исходных веществ (реагентов) или продуктов.
Если в химическую систему, находящуюся в равновесии, добавить какое-либо вещество (реагент или продукт), реакция сместится таким образом, чтобы равновесие восстанавливалось в результате поглощения части добавленного вещества. И наоборот, удаление из равновесной системы какого-либо вещества приводит к смещению равновесия в направлении, соответствующем образованию дополнительного количества данного вещества. Следовательно, при уменьшении концентрации реагентов или увеличении концентрации продуктов реакции равновесие смещается в сторону образования исходных веществ (обратная реакция). При уменьшении концентрации продуктов или увеличении концентрации реагентов химическое равновесие будет смещаться в сторону образования дополнительного количества продуктов реакции (прямая реакция).
2) Влияние изменений давления и объема
Если повышать полное давление системы, находящейся в состоянии равновесия, путем уменьшения ее объема, то в системе произойдет смещение равновесия в сторону уменьшения объема.
Практически это означает, что смещение происходит в сторону уменьшения числа молей газа в системе. И наоборот, уменьшение давления в результате увеличения объема приводит к смещению реакции в сторону образования дополнительного количества молекул газа. Для реакции Н2(г) + I2(г) ↔ 2HI(г) изменение полного давления не влияет на положение равновесия. В данном случае число молекул газообразного продукта совпадает с числом молекул газообразных реагентов.
Важно запомнить, что изменение полного давления при постоянной температуре не приводит к изменению величины константы равновесия К. Изменение давления приводит только к изменениям концентраций газообразных веществ.
3) Влияние изменений температуры
Изменения концентраций или полного давления могут вызывать смещение равновесия, но константа равновесия при этом не изменяется. Однако перемены температуры влияют на величину констант равновесия почти всех реакций.
Можно сформулировать следующее правило: если к равновесной системе, находящейся при постоянном давлении, подводить теплоту, то равновесие сместится в сторону поглощения теплоты (эндотермическая реакция). И наоборот, если теплоту отводить из равновесной системы, то равновесие сместится в сторону выделения теплоты (экзотермическая реакция).
Константы равновесия всех экзотермических реакций, то есть тех, которые протекают с выделением теплоты, при повышении температуры уменьшаются, а константы равновесия эндотермических реакций - увеличиваются.
Зависимость скорости реакции от агрегатного состояния. Рассматривая кинетику химических реакций, следует иметь в виду, что характер взаимодействия зависит от агрегатного состояния реагентов и продуктов. Продукты и реагенты, взятые вместе, образуют физико-химическую систему. Если они образуют однородную систему, в которой между участвующими в ней веществами отсутствуют поверхности раздела (смесь газов, растворы жидких компонентов и т.д.), то система называется гомогенной. Если же в системе имеются поверхности раздела (например, газ - жидкость, газ - твердое), отделяющие реагирующие вещества, то такую систему называют гетерогенной (разнородной).
Концентрация реагирующих веществ и температура влияют на скорость гомогенной химической реакции. Наличие поверхностей раздела в гетерогенной среде приводит к тому, что химическая реакция будет происходить на поверхности раздела фаз. Как правило, именно эти стадии реакции являются лимитирующими — наиболее медленными стадиями реакции.
Очевидно, что с повышением площади соприкосновения реагентов, при прочих одинаковых условиях, скорость поверхностных реакций будет возрастать.
Влияние давления на скорость реакции. Повышение давления приводит к сжатию, а следовательно, и к повышению плотности вещества. Это эквивалентно повышению концентрации веществ в единице объема. Поэтому обычно с повышением давления скорость химической реакции возрастает.
Гомогенный и гетерогенный катализ. Одно из наиболее эффективных средств воздействия на скорость химической реакции — применение катализаторов. Катализатор — вещество, которое изменяет скорость реакции, а само к концу процесса остается неизменным как по составу, так и по массе. Иначе говоря, в момент самой реакции катализатор активно участвует в химическом процессе, как и исходные вещества, но к концу реакции между ними возникает промежуточное различие — исходные вещества изменяют свой химический состав, превращаясь в продукты, а катализатор выделяется в первоначальном виде.
Каталитическое действие связано с понижением энергии активации химической реакции в присутствии катализатора за счет его активного участия в образовании промежуточных соединений с исходными веществами.
Таким образом, действие катализатора сводится к изменению механизма химической реакции, протекающей по энергетически более выгодному пути.
Существуют два вида катализов — гомогенный и гетерогенный. При гомогенном катализе исходные вещества, продукты и катализатор находятся в одинаковом агрегатном состоянии (газ, жидкость) и между ними отсутствует поверхность раздела. При гетерогенном катализе катализаторы (обычно твердые вещества) находятся в другом агрегатном состоянии, чем исходные вещества и продукты реакции. Реакция развивается на поверхности твердого катализатора, на котором адсорбируются молекулы исходных веществ. При этом связи внутри адсорбированных молекул ослабевают и они с меньшими энергетическим затратами превращаются в продукты реакции.
Пример 1. Как изменится скорость реакции между сернистым ангидридом и кислородом 2SO2 + O2 → 2SO3, если уменьшить объем смеси в три раза?
Решение. Концентрации сернистого ангидрида и кислорода до изменения объема:
[SO2] = а; [O2] = b. При этих условиях скорость реакции равна V = k • а2 • b.
Вследствие уменьшения объема в три раза, концентрации сернистого ангидрида и кислорода во столько же раз увеличилась, т. е. [SO2] = 3а, [O2] = 3b.
При новых концентрациях скорость реакции увеличилась в 27 раз.
Пример 2. Составьте выражение для константы равновесия каждой из следующих реакций:
а) N2(г) + ЗН2(г) ↔ 2NН3(г)
б) 2NН3(г) ↔ N2(г) + 3Н2(г)
в) 2Н I (г) ↔ Н 2(г)+ I2(г)
Решение. а) Выражение для константы равновесия имеет вид дроби. В числителе этой дроби стоит произведение концентраций продуктов, причем каждая из концентраций возведена в степень, равную стехиомeтpическому коэффициентy при соответствующем веществе в полном уравнении реакции. Знаменатель дроби получают аналогичным образом из концентраций реагентов: K = [NН3]2/ [N2][Н2]З
б) данная реакция является обратной по отношению к реакции
а), меняя местами реагенты и продукты, находим K = [N2] [Н2]3 / [NН3]2
Отметим, что полученное выражение представляет собой величину, обратную выражению для константы равновесия реакции а). Здесь мы столкнулись с общим правилом, согласно которому выражение для константы равновесия прямой реакции обратно выражено для нее обратной. Точно так же и численное значение константы равновесия для реакции в одном направлении обратно ее значению в обратном.
в) K = [H2][I2] / [HI]2 .
Пример 3.В какую сторону смещается равновесие реакции при увеличении давления? N2(г) + 3Н2 (г) ↔ 2NH3 (г)
Решение. В реакции происходит образование 2 молей газа (2NH3 в правой части уравнения) из 4 молей газообразных реагентов (1N2+ 3Н2 в левой части уравнения). Следовательно, повышение полного давления должно привести к образованию дополнительного количества NH3. Повышение давления смещает реакцию в сторону уменьшения числа молекул газа.
Пример 4.При каких температурах выгоднее проводить реакцию:
2СО 2(г) ↔ 2СО(г) + О2 (г), DH > 0
Решение. Так прямая реакция является эндотермической, то при повышении температуры равновесие смещается в сторону продуктов реакции. Следовательно, чтобы повысить выход продуктов реакции процесс нужно проводить при высоких температурах.
Контрольные вопросы
72. От чего зависит скорость химической реакции?
73. Объясните влияние температуры на скорость химической реакции.
74.Каким законом описывается влияние концентрации реагирующих веществ на скорость химической реакции?
75.Объясните роль катализатора в увеличении скорости химической реакции.
76.Каким принципом объясняется смещение химического равновесия?
77.Укажите, какие из нижеприведенных систем являются гомогенными, а какие гетерогенными:
а) ВаС12 (ж) + Na2SО4 (ж) = 2NaCI (ж) + BaSО4 (т)
б)N2(г) + О2(г) =2NO(г)
в) СО (г) + Н2О (г) = СO2 (г) + Н2 (г)
г) FeO (тв) + СО (г) = Fe (к) + СO2 (г)
д) СаСОз (тв) = СаО (тв) + СO2 (г)
78. Газовая смесь состоит из водорода и хлора. Реакция идет по уравнению
Н2 + Сl2 = 2 HCI . Как изменится скорость реакции, если увеличить давление в три раза?
79. Взаимодействие между оксидом углерода и хлором идет по уравнению
СО + С12 = СОС12 Концентрация оксида углерода 0,3 моль/л, а хлора - 0,2 моль/л. Как изменится скорость прямой реакции, если увеличить концентрацию хлора до 0,6 моль/л, а концентрацию оксида углерода до 1,2 моль/л?
80. Как изменится скорость реакции, протекающей в закрытом сосуде, если увеличить давление в четыре раза? 2NO + O2 →2NO2 ,
81. При нагревании двуокиси азота в закрытом сосуде до некоторой температуры равновесие реакции установилось при следующих условиях: 2NО2 = 2NO + O2
[NO2] = 0,06 моль/л; [NO] = 0,24 моль/л. Найдите константу равновесия для этой температуры и исходную концентрацию двуокиси азота.
82. Почему при изменении давления смещается равновесие реакции
N2 + 3H2 = 2NH3
и не смещается равновесие реакции N2 + O2 = 2NO?
83. В какую сторону сместятся равновесия реакций:
a) 2H2S = 2Н2 + S2 - 9,6 ккал
б) N2O4 = 2NO2- 15,92 ккал
в) СО + Н2O (пар) = СО2 + Н2 - 9,8 ккал
1) при понижении температуры; 2) при повышении давления?
84. Как отразится повышение давления на следующих равновесиях:
2Н2(г) + O2(г)=2Н20(пар)
СO2 + С (тв) = 2СО (г)
СаСОз (тв) = СаО (тв) + СО2 (г)
85. Реакция восстановления двуокиси углерода углем выражается уравнением
СO2 (г) + С (тв) = 2СО (г) - 41,2 ккал. В какую сторону сместится равновесие при повышении температуры? Нарушится ли равновесие системы при увеличении давления?
86. Как повлияет повышение давления при неизменной температуре на равновесие следующих систем:
а) 2НВr = Н2 + Вr2 - 17,3 ккал
б) 2СО + O2 = 2СO2 + 135,2 ккал
в) N2 + O2 = 2NO + 43,2 ккал
В какую сторону сместятся равновесия при повышении температуры? Нарушится ли равновесие системы при увеличении давления?
87. Как повлияет увеличение давления в следующих системах:
a) SO2(г) + Cl2(г) = SO2Cl2(г); б) Н2(г) + Вг2(г) = 2НВг(г)
88. Как повлияет уменьшение температуры на равновесие в следующих системах:
а) А+В = 2С, ∆H=50кДж ; б) 2D + Е= 2F, ∆Н = - 80 кДж.
89. Как надо изменить температуру и давление (увеличить или уменьшить), чтобы равновесие в реакции разложения карбоната кальция
СаСОз (к) ↔ СаО (к) + СO2 (г) ∆Н - 178 кДж
сместить в сторону продуктов разложения? Ответ поясните.
90. При определенных условиях реакция хлороводорода с кислородом является обратимой
4НС1 (г) + O2 (г) ↔ 2С12 (г) + 2Н2O (г) ∆Н = - 116,4 кДж
Какое влияние на равновесное состояние системы окажут:
а) увеличение давления; б) повышение температуры; в) введение катализатора?
91. Является ли реакция распада пероксида водорода обратимой?
92.Почему железная окалина при нагревании в непрерывном токе водорода восстанавливается в металлическое железо полностью, хотя восстановление водородом железной окалины относится к обратимым реакциям?
93.При сжигании угля образуется углекислый газ и при этом наблюдается обратимая реакция С + О2 ↔ 2СО + Q
При каких условиях образуется минимальное количество угарного газа?
94. Изменится ли состояние равновесия, если смесь газов сжать?
Н2 + С12 ↔ 2HCI
95. Изменится ли давление в замкнутой системе, если при нормальных условиях смешать равные объемы хлора и водорода и облучать ультрафиолетовыми лучами? Ответ поясните.
96. Почему железные опилки при нагревании в непрерывном потоке водяного пара до конца окисляются в железную окалину, хотя окисление железа водяным паром относится к обратимым реакциям?
97. В какую сторону сместится равновесие системы 2O3 ↔ 3O2 +Q
а) при повышении температуры; б) повышении давления?
98. Как повлияет на равновесие следующей системы: 2СО + О2 ↔ 2СO2 +Q
а) повышение давления;
б) повышение температуры;
в) увеличение концентрации кислорода.
99. Какова относительная скорость прямой реакции по сравнению с обратной в состоянии равновесия для следующих процессов:
а) 2NО2 ↔ N2О4
б) С12 + Н2O ↔ НСlO + НС1
100. Что получится при действии гидроксида натрия на смесь равных объемов оксида азота (II) и оксида азота (III), реагирующих согласно уравнению
NO + NО2 ↔ N2 О3