Активация аминокислот
Для каждой из 20 аминокислот имеется соответствующий фермент, называемый аминоацил-т-РНК-лигазой (АРСазой, или кодазой), который катализирует соединение определенной аминокислоты с соответствующей ей специфической т-РНК (специфичность т-РНК определяется составом нуклеотидов антикодона в антикодоновой петле т-РНК). Процесс активации аминокислот называют термином «рекогниция», т.е. узнавание.Активация аминокислот необходима не только по тому, что только в активированном состоянии они способны к образованию пептидных связей, но и потому, что аминокислоты сами по себе не способны узнавать кодоны м-РНК (как было отмечено выше, эту роль выполняют т-РНК).
Активация аминокислот локализована в цитоплазме, осуществляется в две стадии. На первой стадии аминокислота связывается в активном центре кодазы, специфичной к этой аминокислоте, и реагирует с АТФ, образуя высокоэнергетический ангидрид – аминоациладенилат (аа-аденилат). Например, активацию пролина можно представить следующей упрощенной схемой:

На второй стадии активированный остаток аминокислоты (в нашем случае –остаток пролина) переносится за счет энергии АТФ с аминоациладенилата (аа) (в нашем случае – с пролил-аденилата) на концевую 3′-ОН-группу концевого остатка рибозы т-РНКаа (у нас т-РНКпро), в результате образуется сложноэфирная связь между остатком аминокислоты и остатком рибозы 3′-концевого остатка аденозина, входящего в последовательность нуклеотидов 3′-конца т-РНК (-ЦЦА 3′). Процесс переноса можно отразить следующей схемой:
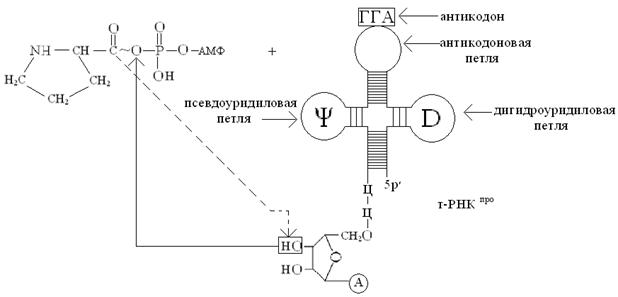
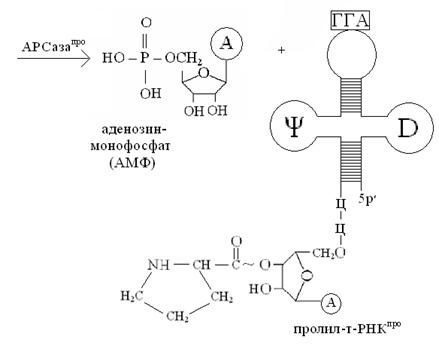
Обратите внимание, что присоединение аминокислот к специфичным т-РНК сопровождается переносом энергии, которая используется на образование пептидных связей (– CONH –) между аминокислотами в процессе биосинтеза белка на рибосоме!
Точность трансляции зависит от субстратной специфичности АРСаз как в отношении т-РНК, так и соответствующей ей аминокислоты. АРСазы способны распознавать и исправлять свои собственные ошибки. Например, из-за того, что радикалы аминокислот валина и изолейцина структурно очень похожи друг на друга, можно было ожидать, что на место изолейцина в полипептидную цепь будет часто встраиваться валин. Однако частота ошибок при включении структурно похожих аминокислот составляет только одну на 1300 аминокислотных остатков. АРСаза обеспечивает немедленное удаление ошибочно присоединенных аминокислотных остатков, катализируя гидролиз «неправильного» аминоациладенилата:
O
|| АРСазаиле
 H2N – CH – C ~ ОАМФ + H2O H2N – CH – COOH + АМФ
H2N – CH – C ~ ОАМФ + H2O H2N – CH – COOH + АМФ
| |
CH(CH3)2 CH(CH3)2
валил-аденилат валин
Затем АРСазаиле начинает все сначала и образует правильный аа-аденилат:
АРСазаиле
 H2N – CH – COOH + АТФ H2N – CH – CO ~ ОАМФ + ррН
H2N – CH – COOH + АТФ H2N – CH – CO ~ ОАМФ + ррН
| |
CHCH3 CHCH3
| |
CH2CH3 CH2CH3
изолейцин изолейцил-аденилат