Буферные системы
При выполнении анализа иногда необходимо поддерживать в исследуемом растворе определённую концентрацию ионов Н+, которая не должна изменяться при хранении, разбавлении раствора, добавлении к нему небольших количеств сильной кислоты или щелочи. Для этих целей в аналитической практике применяют буферные растворы или буферные системы, представляющие собой смеси электролитов, содержащие одноименные ионы.
Различают два типа буферных систем:
- смесь слабой кислоты и её соли, например, ацетатный буферный раствор;
- смесь слабого основания и его соли, например, аммонийный буферный раствор.
Механизм действия ацетатного буферного раствора:
Состав: СН3СООН + СН3СООNa
Уксусная кислота – слабый электролит, диссоциирует по схеме:
СН3СООН ↔ СН3СОО- + Н+
Причем, равновесие диссоциации смещено в сторону недиссоциированных молекул.
Ацетат натрия – сильный электролит, диссоциирует по схеме:
СН3СООNа ↔ СН3СОО- + Na+
Причем, равновесие диссоциации смещено в сторону ионов.
При добавлении к ацетатному буферному раствору небольшого количества щелочи (NaOH), появляющиеся ионы ОН- связываются с имеющимися в растворе ионами Н+ с образованием слабого электролита Н2О:
ОН- + Н+ ↔ Н2О
Вместо связанных ионов Н+, уксусная кислота, диссоциируя, дает новые. В результате рН раствора изменяется незначительно.
При добавлении небольшого количества кислоты (НСI), появляющиеся в растворе ионы Н+ связываются с присутствующими в растворе ацетат-ионами с образованием слабого электролита СН3СООН:
Н+ + СН3СОО- ↔ СН3СООН
В результате рН раствора также почти не изменяется.
Механизм действия аммиачного буферного раствора:
Состав: NH4OH + NH4CI
Гидроксид аммония – слабый электролит, диссоциирующий по схеме:
NH4OH ↔ NH4+ + OH-
Причем, равновесие диссоциации смещено в сторону молекул.
Хлорид аммония – сильный электролит, диссоциирующий по схеме:
NH4CI ↔ NH4+ + CI-
Равновесие диссоциации смещено в сторону ионов.
 |
Добавление NaOH:
ОН- + NH4+ ↔ NH4OH – слабый электролит В результате
Добавление НСI: рН раствора
Н+ + ОН- ↔ Н2О – слабый электролит почти не изменяется
Расчет значений рН буферных систем.Буферные смеси, состоящие из слабой кислоты и её соли:
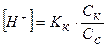 , (15)
, (15)
рН = - lg [H+],
где Кк – константа диссоциации кислоты; Ск и Сс – концентрации соответственно кислоты и соли (моль/л).
Буферные смеси, состоящие из слабого основания и его соли:
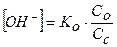 , (16)
, (16)
рОН = - lg [OH-],
рН = 14 – рОН,
где Ко – константа диссоциации основания; Со и Сс – концентрации соответственно основания и соли (моль/л).