Вычисления fЭ, эквивалента и молярной массы эквивалента
Пример 1. Вычислить молярную массу эквивалента H2SO4.
Решение.
1. В реакциях многопротонных кислот могут участвовать все ионы водорода или только часть их:
H2SO4 + NaOH ↔ NaHSO4 + H2O
H2SO4 + 2NaOH ↔ Na2SO4 + 2H2O
2. Из уравнений следует: в первой реакции одному иону водорода соответствует 1 моль серной кислоты: fЭ = 1; во второй – одному иону водорода эквивалентна ½ моль H2SO4; fЭ = ½.
3. Для первой реакции Э (H2SO4)=1 H2SO4; для второй Э (H2SO4)=½ H2SO4.
4. Следовательно,  = 98,08 г/моль (реакция 1)
= 98,08 г/моль (реакция 1)
 = ½ 98,08 = 49,04 г/моль (реакция 2)
= ½ 98,08 = 49,04 г/моль (реакция 2)
Пример 2. Вычислить молярные массы эквивалента H2С2O4.в реакциях нейтрализации и окисления-восстановления.
Решение.
а) H2C2O4 + 2NaOH ↔ Na2C2O4 + 2H2O
б) H2C2O4 + 2KMnO4 + H2SO4 ↔ 10CO2 + 2MnSO4 + K2SO4 + 8H2O
Из уравнения «а» следует, что в реакцию нейтрализации вступают два иона водорода Н2С2О4, следовательно, одному иону водорода соответствует ½ моль Н2С2О4; fЭ (Н2С2О4) = ½.
Из полуреакции уравнения «б» C2O42– – 2ē ↔ 2CO2 видно, что одному электрону эквивалента ½ моль Н2С2О4; fЭ (Н2С2О4) = ½.
В обеих реакциях МЭ (Н2С2О4) = fЭ × М = ½ × 126,08 г/моль = 63,04 г/моль.
Вычисления концентрации растворов
Концентрация раствора есть число, показывающее, сколько растворенного вещества содержится в массовой или объемной единице раствора.
Способы выражения концентрации раствора:
Процентная концентрация (массовая доля %) – масса растворенного вещества в 100 г раствора: 
В количественном химическом анализе используют растворы точной концентрации (молярной, молярной концентрации эквивалента).
Молярная концентрация (См, М) – количество растворенного вещества (в молях) в 1 дм3 раствора.
Молярная концентрация эквивалента (СЭ, N, н) – количество вещества эквивалента (в молях) 1 дм3 (л) раствора.
СМ = n (X) / V; СМ = m × 1000 / M × V
СЭ = nэкв (Х) / V; СЭ = m × 1000 / MЭ × V
Если фактор эквивалентности вещества равен 1, то СМ = СЭ.
Растворы точной концентрации, предназначенные для титрования, называют титрованными растворами. Кроме вышеуказанных способов (СМ, СЭ), их концентрация также выражается через титр раствора, титр раствора по определяемому веществу.
Титр раствора – масса вещества в 1 см3 (мл) раствора.
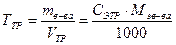
Титр раствора по определяемому веществу (титр соответствия, титриметрический фактор пересчета) – масса определяемого вещества, соответствующая 1 см3 (мл) титрованного раствора.

Такие растворы характеризуются также коэффициентом поправки Кп – числом, показывающим, во сколько раз приготовленный раствор крепче или слабее по сравнению с теоретически заданной концентрацией.
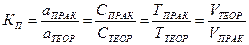
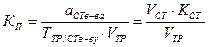
(для стандартных растворов) (для стандартизованных растворов)
Пример 3. 5 г Na2SO4 растворили в 100 г воды. Рассчитать массовую долю растворенного вещества в растворе.
Решение.
1. Вычисляют массу полученного раствора
m = m1 + m2,
где m1 – масса вещества; m2– масса растворителя.
m = 5 + 100 = 105,0000 г раствора
2. Рассчитывают массовую долю вещества, составляя пропорцию:
105 – 100%
5 – х% 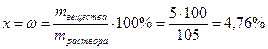
Пример 4. Из 2,5000 г Na2CO3 приготовлено 500 см3 раствора. Вычислить для этого раствора  , СМ, СЭ.
, СМ, СЭ.
Решение.
1. Для вычисления титра находят массу вещества, содержащуюся в 1 см3 раствора
 г/см3
г/см3
2. Молярную концентрацию вычисляют по формуле
 моль/дм3
моль/дм3
3. Молярную концентрацию эквивалента можно найти двумя путями:
а) Находят молярную массу эквивалента Na2CO3
МЭ = ½ М = ½ 105,99 = 53 г/моль
Затем можно воспользоваться известным титром раствора
 моль/дм3
моль/дм3
б) Или можно воспользоваться величиной навески:
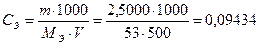 моль/дм3
моль/дм3
Пример 5. Определить массовую долю AgNO3 в 0,05 моль/дм3 раствора (r=1 г/дм3).
Решение.
1. Рассчитывают 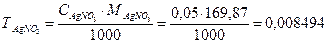 г/см3.
г/см3.
2. Вычисляют массу вещества в 1 дм3 раствора:

3. Находят содержание вещества в 100 см3 (100 г) раствора нитрата серебра:
 , значит: 0,85%-ный раствор нитрата серебра.
, значит: 0,85%-ный раствор нитрата серебра.