ЭТАЛОННЫЙ МЕТОД ОПРЕДЕЛЕНИЯ ПРЕДЕЛА СОДЕРЖАНИЯ ОБЩИХ ТЕХНОЛОГИЧЕСКИХ ПРИМЕСЕЙ
Сущность эталонного метода определения предела содержания данной примеси заключается в том, что испытуемый раствор примеси, содержащейся в лекарственном веществе, готовят таким образом, чтобы ожидаемая концентрация примеси в нем была равна концентрации этой примеси в эталонном растворе. Следовательно, испытуемый раствор готовят так, чтобы выполнялось условие:
СО = СЭ (1)
где: СО – ожидаемая концентрация данной примеси в испытуемом растворе, %.
СЭ – концентрация эталонного раствора данной примеси, %.
Эталонным раствором данной примеси называют раствор с точно известной концентрацией примеси, приготовленный из стандартного образца примеси в соответствии с требованиями нормативно-технической документации (ГФХ, стр. 748-754).
Введем следующие обозначения:
· СЭ– концентрация данной примеси в эталонном растворе, %;
· СН– нормированный предел содержания примеси в препарате, %;
· СЧ – чувствительность метода открытия примеси, равная минимальной открываемой концентрации, %;
· А– навеска препарата, взятая для приготовления раствора примеси, г;
· V – объем приготовленного раствора примеси, мл;
· Р – кратность разведения приготовленного раствора при приготовлении из него испытуемого раствора.
Нормированный предел содержания примеси (СН) для каждого конкретного лекарственного вещества имеет одно определенное значение, которое устанавливается производителем.
Под испытуемым раствором примеси понимают раствор, приготовленный из анализируемого препарата в соответствии с требованиями нормативно-технической документации (ФС, ФСП).
Ниже на рисунке 1 показаны операции, которые выполняются при приготовлении испытуемого раствора примеси из навески лекарственного вещества для проведения испытания на чистоту эталонным методом. Собственно испытание заключается в сравнении величин мутности или окраски, возникающих в испытуемом и эталонном растворах после проведения стандартной обработки их реактивами.
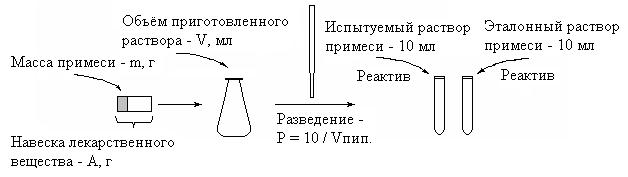
Р и с. 1. Схема приготовления испытуемого раствора примеси
в эталонном методе
Конечно, действительная концентрация примеси в испытуемом растворе может оказаться и больше и меньше ожидаемой концентрации. Это становится ясным после проведения испытания и сравнения величин проявлений в испытуемом и эталонном растворах. Обычно для открытия примесей используют осадочные или цветные реакции, которые должны быть специфичными для данной примеси, высокочувствительными и воспроизводимыми.
Ясно, что сравнивая величины проявлений в испытуемом и эталонном растворах, например, величины мутности растворов, визуально или с помощью приборов, можно судить не только о концентрации примеси в испытуемом растворе, но и о концентрации примеси в анализируемом лекарственном веществе, поскольку величина. СО связана с величиной СН функциональной зависимостью. Очевидно, что нормированная масса примеси в препарате (m, г) должна быть меньше и лишь в предельном случае равна:
m = А·СН / 100 (2)
Концентрация примеси в приготовленном растворе (СПР, %)объемом V составит:
СПР = m·100 / V(3)
После подстановки уравнения 2 в уравнение 3 имеем:
СПР = А·СН / V(4)
В общем случае после проведения разведения приготовленного раствора имеем:
СО = СПР / Р = А·СН / V·Р (5)
После подстановки в уравнение 5 уравнения 1 и преобразования получаем основное уравнение 6, отражающее сущность эталонного метода:
СН = СЭ·V·Р / А(6)
Очевидно, что в том случае, если после проведения испытания величина мутности или окраски эталонного раствора меньше, чем испытуемого, то это значит, что концентрация примеси в анализируемом препарате больше нормированного предела ее содержания. Напротив, если величина мутности или окраски испытуемого раствора меньше, чем эталонного раствора, то можно утверждать, что концентрация данной примеси в препарате меньше нормированного предела ее содержания.
Ряд примесей (кальций, железо, тяжелые металлы) в органических лекарственных веществах, нерастворимых в воде, определяют после их озоления. Полученную золу растворяют в подходящей кислоте (уксусной или хлористоводородной) доводят водой до 10 мл, после чего проводят испытание. Очевидно, что общая формула (6) в этом случае сведется к частной формуле вида:
СН = СЭ·10 / А(7)
Определение примеси мышьяка эталонным методом проводится в специальном приборе (см. стр. ). При этом сравнивается окраска индикаторных полосок бумаги, возникающая вследствие действия газообразного арсина, образующегося в реакционных колбах с испытуемым и эталонным образцами.
Очевидно, что в этом случае справедливо соотношение – масса мышьяка в испытуемом образце (mисп.) равна массе мышьяка в эталонном растворе (mэ):
mисп. = mэ (8)
Вводя нормированный предел содержания мышьяка в препарате имеем:
А·СН = СЭ·VЭ(9)
где: величины А, СНиСЭ·имеют указанный ранее смысл, а VЭ– объем эталонного раствора, взятый для анализа. В фармакопейной методике определения примеси мышьяка всегда используется один и тот же эталонный раствор с концентрацией 0,0001% объемом 0,5 мл, что позволяет свести формулу (9) к виду:
СН =0,00005 / A (10)
Для определения области применения эталонного метода в фармакопейном анализе рассмотрим пределы изменения различных величин, входящих в уравнение (6).
Величина СН. Нормативные требования к чистоте лекарственных веществ, характеризуются наличием лишь одного предела содержания данной примеси (СН) в данном препарате. В то же время для различных лекарственных веществ предел содержания примеси (СН) может быть различным. Следовательно, величина СН для лекарственного вещества является величиной постоянной, а для всей совокупности лекарственных веществ – величиной переменной, принимающей ряд дискретных значений. Так, например, значения пределов содержания хлоридов в препаратах: анестезин. магния сульфат, изониазид и нафтизин различны и равны соответственно, 0,002, 0,004, 0,01 и 0,02% (ГФХ, ст. №№ 55, 383, 357,421). Таким образом, в фармакопейном анализе возникает задача контроля различных значений СН для большой совокупности лекарственных веществ, но каждое из них характеризуется только одним значением СН.
Иная ситуация имеет место в техническом анализе химических реактивов и продуктов. Каждый химический реактив, который производит предприятие имеет несколько квалификаций, каждой из которых соответствует своя величина предела содержания данной примеси. Качество продукции различают только по наличию примесей.
Присвоение квалификации данной партии химического продукта производится центральной заводской лабораторией (ЦЗЛ) по результатам контроля его чистоты эталонным методом.
И в фармакопейном и в техническом анализе для контроля пределов содержания примесей используется эталонный метод, но способы организации контроля чистоты различны.
В формализованном виде способ организации контроля чистоты в техническом анализе можно представить так:
 V·Р / А –const. (постоянная);
V·Р / А –const. (постоянная);
СЭ ~ (дискретная переменная, величины которой
соответствуют различным квалификациям).
Эти условия означают, что приготовление испытуемого раствора для анализа данного продукта всегда одинаково, а эталонных растворов с различной концентрацией (СЭ) готовят столько, сколько сортов имеет данный продукт.
Например, уксусный ангидрид выпускается двух квалификаций – ч.д.а. и ч.. По техническим требованиям содержание хлоридов для ч.д.а. не должно быть более 0,0003% и для ч. – 0,0005%.
Количество испытаний на каждую примесь определяется числом квалификаций, но для всех испытаний всегда берут навеску 5 г и готовят 27 мл раствора (V·Р / А –const.). Эталонные растворы на хлорид-ион соответственно используют двух концентраций – 0,0000556% для ч.д.а. и 0,0000926% для ч.
 В отличие от этого, в фармакопейном анализе используют только один эталонный раствор данной примеси при испытаниях различных лекарственных веществ, если в нормативно-технической документации на данный препарат нет дополнительных указаний по приготовлению особого эталонного раствора. А вот испытуемые растворы из различных лекарственных веществ готовят различной концентрации, но так, чтобы величина V·Р / А удовлетворяла уравнению (6).
В отличие от этого, в фармакопейном анализе используют только один эталонный раствор данной примеси при испытаниях различных лекарственных веществ, если в нормативно-технической документации на данный препарат нет дополнительных указаний по приготовлению особого эталонного раствора. А вот испытуемые растворы из различных лекарственных веществ готовят различной концентрации, но так, чтобы величина V·Р / А удовлетворяла уравнению (6).
СЭ – const. (постоянная);
V·Р / А ~ (переменная).
Итак, фармакопейный анализ характеризуется тем, что концентрация эталонного раствора данной примеси – величина постоянная, а методика приготовления испытуемых рaстворов (навеска, приготовляемый объем и разведение) из различных лекарственных веществ может быть различной.
Величина СЭ. Возникает вопрос: какова должна быть концентрация эталонного раствора данной примеси? Очевидно, что концентрация эталонного раствора примеси не может быть меньше чувствительности метода открытия этой примеси.
Действительно, если концентрация эталонного раствора будет меньше чувствительности метода открытия данной примеси, то примесь в эталонном растворе просто не будет обнаруживаться и, следовательно, сравнивать испытуемый раствор будет не с чем. Следовательно, нижний предел концентрации эталонного раствора примеси равен чувствительности метода открытия этой примеси. Но концентрация эталонного раствора не должна во много раз превышать чувствительность метода открытия примеси, поскольку тогда будет невозможно точно сравнивать испытуемый и эталонный растворы, особенно если сравнение осуществляется визуально.
В связи с тем, что глаз человека не ощущает различие в интенсивности окраски или степени мутности растворов, если эти различия составляют менее 10%, нецелесообразно использовать эталонные растворы с концентрацией более чем в 10 раз превышающей чувствительность реакции на данную примесь.
С учетом этого диапазон приемлемых концентраций эталонных растворов составляет:
СЧ≤ СЭ< 10·СЧ (11)
Действительно, рекомендуемые ГФХ и ГФХI концентрации эталонных растворов общих примесей лишь в несколько раз превышают чувствительность методов, использующихся для открытия этих примесей. Концентрации эталонных растворов примесей и чувствительности методов их обнаружения, взятые нами из ГФХI, представлены в таблице.
Таблица
Концентрации эталонных растворов общих технологических примесей и чувствительности реакций, лежащих в основе их обнаружения
| Наименование примеси | Чувствительность метода открытия примеси (СЧ), % | Концентрация эталонного раствора примеси (СЭ), % | СЭ/СЧ |
| Хлорид-ион | 0,00005 | 0,0002 | |
| Сульфат-ион | 0,0003 | 0,001 | 3,3 |
| Аммиак | 0,00003 | 0,0002 | 6,7 |
| Кальций-ион | 0,00035 | 0,003 | 8,6 |
| Железо(III)-ион | 0,000005* | 0,0003 | |
| Цинк-ион | 0,0001 | 0,0005 | |
| Свинец-ион | 0,00005 | 0,00005 | |
| Мышьяк** метод 1 метод 2 | 0,0005 мг в образце 0,0001 | 0,0001 (на анализ 0,5 мл) |
* Опечатка следует читать 0,00005
** Испытание на мышьяк осуществляется двумя методами, описанными в ГФХ (стр.753-755): эталонным методом (метод 1) и безэталонным методом (метод 2).
Как видно из таблицы, эталонные растворы общих технологических примесей имеют концентрации, удовлетворяющие рассмотренному условию (1≤СЭ/СЧ<10), за исключением железо(III)-иона. С нашей точки зрения в ГФХ и ГФХI допущена опечатка в величине чувствительности реакции на железо(III)-ион. Маловероятно, что чувствительность этой реакции на порядок превышает чувствительность таких высокочувствительных реакций как реакции на хлорид-ион, аммиак и свинец-ион. Скорее всего чувствительность этой реакции равна 0,00005%, а не 0,000005% как дано в ГФХ.
Величины V и Р. Нижний предел объема приготовляемого раствора – 10 мл. Это обусловлено тем, что в соответствии с требованием ГФХ и ГФХI для испытания необходимо 10 мл раствора.
Эти 10 мл могут быть взяты непосредственно от приготовленного раствора, или получены разведением его части. Верхний предел объема приготовляемого раствора жестко не ограничен, а определяется критериями оптимальности анализа. В подавляющем большинстве случаев он не превышает 100 мл.
В том случае, если необходимый объем раствора слишком велик, используют разведение первоначально приготовленного раствора перед испытанием.
Таким образом, диапазон приемлемых значений объема приготовляемого раствора определяется соотношением:
10 ≤ V <~ 100 (12)
Поскольку, необходимый для проведения испытания объем равен 10 мл, а также в связи с тем, что по требованиям фармакопейного анализа нельзя отбирать для разведения объемы растворов менее 1 мл, приемлемый диапазон разведения приготовленного раствора составляет:
1 ≤ Р ≤ 10(13)
Если лекарственное вещество контролируют на содержание нескольких примесей, целесообразно готовить один раствор, объем которого должен быть достаточным для проведения всех испытаний.
Следует иметь в виду, что для приготовления испытуемого раствора общих технологических примесей нет необходимости, ни в полном растворении самого лекарственного вещества, ни в его отсутствии в испытуемом растворе, поскольку качественные реакции, лежащие в основе испытаний на чистоту, высокоспецифичны. Важным является полный перевод примеси из лекарственного вещества в испытуемый раствор. Поскольку, общие технологические примеси (за исключением мышьяка, определяемого методом 1) могут быть переведены в водный раствор, в качестве растворителя для приготовления испытуемых растворов целесообразно использовать воду.
В практике анализа известны следующие способы приготовления испытуемых растворов общих технологических примесей:
1. Полное растворение лекарственного вещества вместе с примесью в воде;
2. Полное растворение лекарственного вещества вместе с примесью в воде и удаление лекарственного вещества из раствора в том случае, если оно мешает определению примеси;
3. Экстракция примеси из нерастворимого полностью лекарственного вещества водой путем: а) встряхивания препарата в течение 2-5 минут с водой и фильтрования, б) нагревания суспензии до кипения, охлаждения сразу после закипания до комнатной температуры и фильтрования.
4. Озоление органического лекарственного вещества, растворение зольного остатка в уксусной (при определении кальция) или хлористоводородной кислоте (при определении железа и тяжелых металлов) и доведение объёма испытуемого раствора до 10 мл.
В некоторых случаях для улучшения экстракции примесей к суспензии добавляют вспомогательные реактивы, не мешающие последующему определению.
Следует отметить, что известны ФС, которые в качестве растворителя при определении общих технологических примесей рекомендуют использовать этиловый спирт (например, ГФХ, ФС 55 на анестезин), что с нашей точки зрения нецелесообразно, поскольку цель анализа не растворить анализируемое соединение, а растворить общие технологические примеси, содержащиеся в нем.
В тех методах, когда в процессе приготовления испытуемого раствора применяется фильтрование, необходимо при планировании объема воды (V) учесть ее потери на фильтрование (~2-5 мл).
В некоторых случаях, когда нормированный предел содержания примеси очень мал, возникает необходимость разбавления стандартного эталонного раствора, как, например, при анализе воды дистиллированной на аммиак (ГФХ, ФС 73). При этом необходимо помнить, что величина концентрации специально приготовленного эталонного раствора не должна быть меньше чувствительности метода ее открытия. Следовательно, кратность разведения стандартного эталонного раствора не должна превышать величину – СЭ/СЧ.
Величина А.Нижний предел навески лекарственного вещества, необходимой для приготовления испытуемого раствора, составляет 0,1 г. Это обусловлено 2 факторами: 1) тем, что взвешивание лекарственных веществ при контроле их чистоты осуществляется с точностью до 0,01 г; 2) и тем, что нормативная относительная ошибка эталонного метода контроля чистоты составляет 10%.
0,1 г ≤ А(14)
Верхний предел навески не имеет строго ограниченного значения.
Как показывает анализ фармакопейных методик, в большинстве случаев навеска не превышает 2 г. Большие навески берут тогда, когда необходим контроль большого числа примесей в препарате.
В этой ситуации целесообразно приготовить один раствор из одной навески, а из него готовить испытуемые растворы для контроля различных примесей.
Так, например, при контроле чистоты угля активированного 10 г препарата используют для приготовления раствора, из которого получают испытуемые растворы для определения примесей сульфидов, тяжелых металлов, железа и веществ, растворимых в разведенной соляной кислоте. Оптимальным следует считать такой метод контроля чистоты лекарственного вещества, который предусматривает использование минимального числа навесок препарата с минимальными допустимыми их значениями.
Более подробно вопросы оптимизации методик приготовления испытуемых растворов будут рассмотрены ниже в разделе 1.2.5. Планирование методик контроля общих технологических примесей.