V А тобы элементтеріне жалпы сипаттама.
|
 - типтік элементтер, т.э.а.
- типтік элементтер, т.э.а.
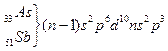

VА тобы элементтері – 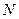 ,
, 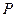 ,
,  ,
,  ,
, 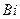 - галогендер және халькогендер терминдеріне ұқсас «пниктогендер» деп аталады, атау типтік элементтер
- галогендер және халькогендер терминдеріне ұқсас «пниктогендер» деп аталады, атау типтік элементтер 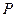 мен
мен 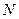 символдарынан түзілген. Жоғарыдан төмен топ бойынша электрондық қабаттың артуына байланысты элементтер қасиеттерінің өзгерісінде екіншілей периодтық байқалады.
символдарынан түзілген. Жоғарыдан төмен топ бойынша электрондық қабаттың артуына байланысты элементтер қасиеттерінің өзгерісінде екіншілей периодтық байқалады.
Типтік элементтер азот пен фосфор арасында айтарлықтай айырмашылық бар:
1) жай зат азот – газ, жай зат фосфор – қатты зат;
2) ақ фосфор  молекулалық азотқа (
молекулалық азотқа (  ) қарағанда анағұрлым химиялық активтірек;
) қарағанда анағұрлым химиялық активтірек;
3) атомдық азот, атомдық фосфорға қарағанда активтірек;
4) 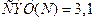 ,
, 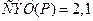 ;
;
5) азоттың атомдық радиусы (0,052 нм) фосфордан ~1,8 еседей аз.
Себебі: 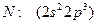
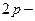 орбиталь кайносимметриялы,
орбиталь кайносимметриялы, 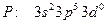 кайносимметриялы орбиталь жоқ, фосфорда бос
кайносимметриялы орбиталь жоқ, фосфорда бос  орбиталь бар, сондықтан оның электрондары азотқа қарағанда ядромен әлсіз байланысқан.
орбиталь бар, сондықтан оның электрондары азотқа қарағанда ядромен әлсіз байланысқан.
Егер азот қос және үш байланыс түзуге ұмтылса, үлкен радиусты фосфор керісінше 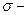 байланыстарын және полимерлі қосылыстар түзуге бейім.
байланыстарын және полимерлі қосылыстар түзуге бейім.
Мышьяк топшасы элементтері (  ) кесек күйінде металдық өткізгіштікке ие. Фосфордан висмутқа
) кесек күйінде металдық өткізгіштікке ие. Фосфордан висмутқа 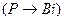 қарай +3 тотығу дәрежесінің тұрақтылығы артады,
қарай +3 тотығу дәрежесінің тұрақтылығы артады,  контракциясы болғандықтан
контракциясы болғандықтан  инертті жұп.
инертті жұп.
Сыртқы электрондарды экрандайтын ішкі  және
және  қатпарлары болғандықтан
қатпарлары болғандықтан  қатарында екіншілей периодтық байқалады. Осының нәтижесінде қатардың ортаңғы элементі сурьма үшін +5 тотығу дәрежесі мышьякқа және висмутқа қарағанда көбірек тұрақты.
қатарында екіншілей периодтық байқалады. Осының нәтижесінде қатардың ортаңғы элементі сурьма үшін +5 тотығу дәрежесі мышьякқа және висмутқа қарағанда көбірек тұрақты.
Теріс тотығу дәрежесі азотқа тән және висмут үшін іс жүзінде іске аспайды. Бұл жағдай висмуттың металл, ал  пен
пен  жартылай металл екендігін сипаттайды.
жартылай металл екендігін сипаттайды.
2. Азот, табиғатта таралуы, алынуы, қасиеттері.
Азоттың табиғаттағы негізі түрі атмосфералық азот (78%, көл.), ол тірі табиғат үшін қажет элемент, белоктар және нуклеин қышқылдарының құрамына кіреді. Азоттың табиғаттағы айналымын білген жөн. Жер қыртысында нитраттар:  ,
, 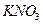 ,
,  түрінде болады.
түрінде болады.
Өнеркәсіпте азотты сұйық ауаны фракциялық айдау арқылы, ал лабораторияда аммоний тұздарын нитритпен қыздырып алуға болады.
Азот, көп мөлшері азот қышқылы өнеркәсібіне жұмсалатын аммиак өндірісінде қолданылады. Газ күйіндегі азот инертті атмосфера жасауда, газ-сұйықты хроматографияда газ тасымалдаушы ретінде пайдаланылады.
Азот – түссіз, иіссіз газ. Молекуласындағы байланыс реті және еселігі үшке тең, сондықтан молекуласы ерекше тұрақты. Суда және органикалық еріткіштерде нашар ериді. -3-тен +5-ке дейін тотығу дәрежесін көрсетеді. Бөлме температурасында тек литиймен әрекеттеседі. Жоғары температурада азот көптеген металдарды және бейметалдарды тотықтырады.
3. Азоттың сутектік қосылыстары.
Азоттың маңызды сутектік қосылысы 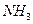 - аммиак. Ол кәдімгі жағдайда түссіз, өткір тұншықтырғыш иісті, улы газ. Алынуы. Өнеркәсіпте:
- аммиак. Ол кәдімгі жағдайда түссіз, өткір тұншықтырғыш иісті, улы газ. Алынуы. Өнеркәсіпте:
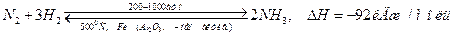
лабораторияда:

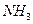 оңай сұйық күйге (
оңай сұйық күйге ( 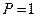 атм-да tсұй=-330C) өтеді, сутектік байланыстың туындауынан ол ассоциацияланады. Сұйық аммиак сусыз ерітінділердің бастамасы болды. Аммиактың суда ерігіштігі: 00С-да 1 көлем
атм-да tсұй=-330C) өтеді, сутектік байланыстың туындауынан ол ассоциацияланады. Сұйық аммиак сусыз ерітінділердің бастамасы болды. Аммиактың суда ерігіштігі: 00С-да 1 көлем 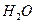 газ күйіндегі аммиактың 1200 көлемін жұтады, ерітінді сілтілік орта көрсетеді. Қышқылдармен әрекеттесіп
газ күйіндегі аммиактың 1200 көлемін жұтады, ерітінді сілтілік орта көрсетеді. Қышқылдармен әрекеттесіп  тұз түзеді. Аммоний тұздарының тән қасиеті термиялық тұрақсыздығы:
тұз түзеді. Аммоний тұздарының тән қасиеті термиялық тұрақсыздығы:
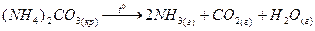
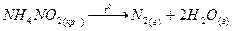
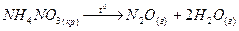
Аммоний ионына реакция: 
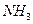 - тотықсыздандырғыш:
- тотықсыздандырғыш: 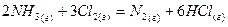
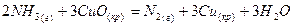
Оттекте жанады: 
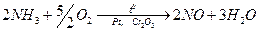
 - гидразин түссіз сұйықтық. Ауада көп жылу бөліп жанатындықтан, тиімді ракеталық отын болып табылады:
- гидразин түссіз сұйықтық. Ауада көп жылу бөліп жанатындықтан, тиімді ракеталық отын болып табылады:

Гидразин – күшті тотықсыздандырғыш:
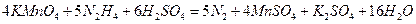


 - гидроксиламин ақ кристалды зат, екі жақты табиғат көрсетеді:
- гидроксиламин ақ кристалды зат, екі жақты табиғат көрсетеді:
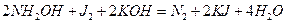
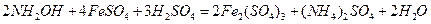
және диспропорцияланады: 
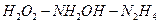 қатарында тотықсандырғыштық активтілігі артып, тотықтырғыштық активтігі кемиді.
қатарында тотықсандырғыштық активтілігі артып, тотықтырғыштық активтігі кемиді.
4. Азоттың оттектік қосылыстары.
Азот оттекпен тікелей қосылғанда (электр доғасы температурасында) тек азот (II) оксиді  түзіледі. Қалған оксидтері азот қышқылы және оның тұздарынан жанама жолмен алынады.
түзіледі. Қалған оксидтері азот қышқылы және оның тұздарынан жанама жолмен алынады.
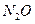 және
және  – тұз түзбейтін оксидтер, қалғандары – тұз түзетіндер.
– тұз түзбейтін оксидтер, қалғандары – тұз түзетіндер.
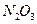 - тек теріс температурада өмір сүреді.
- тек теріс температурада өмір сүреді.
 - азотты қышқыл.
- азотты қышқыл.
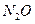 - қоңыр түсті газ. Алынуы:
- қоңыр түсті газ. Алынуы:

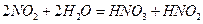
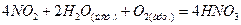
 - түссіз кристалл. Алынуы:
- түссіз кристалл. Алынуы:

 - азот қышқылы, хлор қышқылынан кейінгі күшті қышқыл.
- азот қышқылы, хлор қышқылынан кейінгі күшті қышқыл.
Сақтағанда: 
Оксид қабыршақтарымен қапталғандықтан  ,
,  ,
, 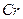 концентрленген
концентрленген  -те пассивтеледі. Азот қышқылына
-те пассивтеледі. Азот қышқылына  ,
, 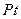 ,
, 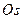 ,
, 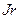 ,
, 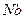 ,
, 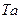 ,
, 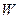 тұрақты.
тұрақты.
 - күшті тотықтырғыш, тотықсыздану өнімі:
- күшті тотықтырғыш, тотықсыздану өнімі:
1)  концентрациясынан;
концентрациясынан;
2) тотықсыздандырғыштың активтілігінен;
3) температурадан тәуелді.
Алынуы. Өнеркәсіпте:
1) катализатор қатысында 8000С температурада аммиакты ауадағы оттек арқылы азот (ІІ) оксидіне тотықтыру процесі:
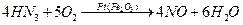
2) азот (ІІ) оксидінің азот (ІV) оксидіне өздігінен тотығуы:
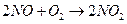
3) азот (ІV) оксидінің еруін оттек қатысуында жүргізсе, тек азот қышқылы алынады:

Лабораторияда:

Тұздары – нитраттар қыздырғанда ыдырайды, металдың активтігіне қарай реакция өнімі нитрит, оксид, бос металл болады.
5. Фосфор, табиғатта таралуы, алынуы, қасиеттері.
Фосфор табиғатта  – апатит,
– апатит,  - фосфорит минералдары түрінде болады, өсімдіктерде және жануарлар мен адам организмінде болады.
- фосфорит минералдары түрінде болады, өсімдіктерде және жануарлар мен адам организмінде болады.
Күкірт сияқты фосфорға да әртүрлі модификациялар түзу тән. Ақ фосфордың кристалдық тор түйіндерінде  молекуласы болады,
молекуласы болады,  гибридтенуі, құрылымы тетраэдр. Ол активті, улы, сондықтан су астында сақтайды. Сақтағанда полимерлі қызыл фосфорға айналады, оның активтігі төмен, улылығы аздау. Техникада алынуы:
гибридтенуі, құрылымы тетраэдр. Ол активті, улы, сондықтан су астында сақтайды. Сақтағанда полимерлі қызыл фосфорға айналады, оның активтігі төмен, улылығы аздау. Техникада алынуы:

Конденсациялағанда қатты күйдегі ақ фосфор түзіледі. Ақ фосфор галогендер, халькогендер, металдармен белсенді әрекеттеседі. Сілтілік және сілтілік-жер металдарымен тұз тәрізді ионды-ковалентті  ,
,  ,
,  , бейметалдармен қышқылдық ковалентті
, бейметалдармен қышқылдық ковалентті  ,
,  фосфидтерін түзеді. Тұтас алғанда, период бойынша фосфидтердің табиғаты әлсіз негіздіктен қышқылдыққа дейін өзгереді.
фосфидтерін түзеді. Тұтас алғанда, период бойынша фосфидтердің табиғаты әлсіз негіздіктен қышқылдыққа дейін өзгереді.
6. Фосфордың бинарлы, күрделі қосылыстары.
 - фосфин - шіріген балыққа ұқсас иісі бар, улы газ. Жанама жолмен алынады:
- фосфин - шіріген балыққа ұқсас иісі бар, улы газ. Жанама жолмен алынады:

 - фосфорлылау қышқыл, бір негізді, фосфордың оттекті қышқылдарының ішіндегі күштісі, тұздары – гипофосфиттер.
- фосфорлылау қышқыл, бір негізді, фосфордың оттекті қышқылдарының ішіндегі күштісі, тұздары – гипофосфиттер.
 оттегі жетімсіз болғанда түзіледі.
оттегі жетімсіз болғанда түзіледі.
 - фосфорлы қышқыл, екі негізді, тұздары – фосфиттер.
- фосфорлы қышқыл, екі негізді, тұздары – фосфиттер.
 - пирофосфорлы қышқыл, екі негізді, тұздары пирофосфиттер.
- пирофосфорлы қышқыл, екі негізді, тұздары пирофосфиттер.
 полимерлі қышқылдар да түзеді, мысалы,
полимерлі қышқылдар да түзеді, мысалы,  - полимерлі метафосфорлы қышқыл.
- полимерлі метафосфорлы қышқыл.
 - фосфорлау қышқылы, төрт негізді, тұздары – гипофосфаттар.
- фосфорлау қышқылы, төрт негізді, тұздары – гипофосфаттар.
 - фосфор (V) оксиді, ақ қатты зат, бу күйінде молекуласының құрамы
- фосфор (V) оксиді, ақ қатты зат, бу күйінде молекуласының құрамы  болады.
болады.  - химиялық байланысқан суды тартып алатын күшті дегидраттаушы агент.
- химиялық байланысқан суды тартып алатын күшті дегидраттаушы агент.
 - фосфор қышқылында (
- фосфор қышқылында (  ) ерігенде 2 типті полимерлі фосфор қышқылдары түзіледі: 1) полифосфор қышқылдары – бір-бірімен ортақ оттек төбелерімен байланысқан
) ерігенде 2 типті полимерлі фосфор қышқылдары түзіледі: 1) полифосфор қышқылдары – бір-бірімен ортақ оттек төбелерімен байланысқан  тобының тізбектерін түзеді. Бұл қышқылдардағы
тобының тізбектерін түзеді. Бұл қышқылдардағы 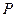 атомының саны 2-ден 20-ға дейін өзгере алады. Мысалы,
атомының саны 2-ден 20-ға дейін өзгере алады. Мысалы,  - тетраполифосфор қышқылы, тұздары – полифосфаттар; 2) полиметафосфор қышқылдары, құрылымы циклді (тұйық). Жалпы формуласы
- тетраполифосфор қышқылы, тұздары – полифосфаттар; 2) полиметафосфор қышқылдары, құрылымы циклді (тұйық). Жалпы формуласы  .
.
 – ортофосфор (фосфор) қышқылы, мөлдір түссіз кристалл. Молекуласында
– ортофосфор (фосфор) қышқылы, мөлдір түссіз кристалл. Молекуласында  гибридтенуі, құрылымы бұрмаланған тетраэдр. Сулы ортада күші орташа қышқыл.
гибридтенуі, құрылымы бұрмаланған тетраэдр. Сулы ортада күші орташа қышқыл.
Өнеркәсіпте алынуы:
1) фосфор (V) оксидін суда ерітіп:

2) экстрация әдісі:

3) термиялық әдіс:

Лабораторияда алынуы:

Үш қатар тұз – дигидрофосфат, гидрофосфат және фосфат түзеді. Сілтілік металдар фосфаттары ерітіндіде гидролизге ұшырайды.
7. Мышьяк топшасы элементтеріне қысқаша шолу.
 ,
,  ,
, 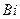 – мышьяк топшасы элементтері.
– мышьяк топшасы элементтері.
Сульфидтік кендерін тотықтырып өртеп оксидке айналдырады, сосын оксидтерін тотықсыздандырып жай заттарын алады.
Активтік қатарда сутектен кейін тұрғандықтан, сұйылтылған қышқылдармен әрекеттеспейді.  және
және  тотықтырғыш – қышқылдармен сәйкес қышқылын түзсе,
тотықтырғыш – қышқылдармен сәйкес қышқылын түзсе, 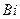 концентрленген
концентрленген  -те пассивтеледі, ал сұйылтылған
-те пассивтеледі, ал сұйылтылған  -те нитрат түзеді, яғни ол металдық қасиет көрсетеді:
-те нитрат түзеді, яғни ол металдық қасиет көрсетеді:

 мышьяк әрекеттеспейді,
мышьяк әрекеттеспейді,  қыздырғанда, ал
қыздырғанда, ал 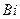 кәдімгі жағдайда әрекеттеседі. Топша элементтері күшті сілтілер ерітінділерімен әрекеттеспейді. Тек
кәдімгі жағдайда әрекеттеседі. Топша элементтері күшті сілтілер ерітінділерімен әрекеттеспейді. Тек  ауаның оттегі қатысуында сілтімен балқытып қыздырғанда арсенат түзеді.
ауаның оттегі қатысуында сілтімен балқытып қыздырғанда арсенат түзеді.
 ,
,  ,
, 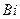 қыздырғанда активті металдар және бейметалдармен әрекеттеседі.
қыздырғанда активті металдар және бейметалдармен әрекеттеседі.  ,
,  - тұз тәрізді қосылыстар.
- тұз тәрізді қосылыстар.
 қатарында негіздік сипаты күшейеді, бірақ тұтас алғанда олар амфотерлі.
қатарында негіздік сипаты күшейеді, бірақ тұтас алғанда олар амфотерлі.
 қатарында гидридтердің термиялық тұрақтылығы, тотықсыздандырғыштық қабілеті және негіздік сипаты кемиді.
қатарында гидридтердің термиялық тұрақтылығы, тотықсыздандырғыштық қабілеті және негіздік сипаты кемиді.
 - қышқылдық,
- қышқылдық,  - амфотерлі,
- амфотерлі,  - негіздік гидроксид.
- негіздік гидроксид.
 ,
,  , висмутқа +5 тотығу дәрежесі жалпы алғанда тән емес, оның қосылыстарын тотықтырғыштар қатысуында алады.
, висмутқа +5 тотығу дәрежесі жалпы алғанда тән емес, оның қосылыстарын тотықтырғыштар қатысуында алады.
 күші бойынша
күші бойынша  -ке жақын,
-ке жақын,  құрамы ауыспалы, висмут қышқылдары бос күйінде бөлінбеген.
құрамы ауыспалы, висмут қышқылдары бос күйінде бөлінбеген.