Определение концентрационной константы гидролиза соли.
Цель нашей работы: определение концентрационной константы гидролиза соли потенциометрическим методом.
Для начала мы подготовили к работе хингидронный электрод. Он представляет собой гладкую платиновую проволоку или пластину в растворе, содержащем небольшое количество хингидрона, т. е. эквимолярного соединения хинона  и гидрохинона
и гидрохинона 
Рис. 7. Конструкция хингидронного электрода

1-отвод;
2-стеклянный сосуд;
3-шлиф;
4-стеклянная трубка с впаянной платиной;
5-раствор хингидрона;
Составили гальваническую цепь из хингидронного электрода и
хлоридсеребряного электрода сравнения
 .
.
Произвели калибровку хингидронного электрода, определяя напряжение цепи Е в нескольких стандартных растворах рН-метрии с известными значениями рН0. Результаты измерений занесли в таблицу 3 (см. приложение).
По этим данным построили график.
Рис. 8. Калибровка хингидронного электрода, определяя напряжение цепи Е в нескольких стандартных растворах рН-метрии с известными значениями рН0
Методом последовательного разбавления приготовили серию растворов ацетата натрия. Концентрации растворов: 0,5; 0,2; 0,1; 0,05; 0,01 и 0,005 М, объем каждого раствора - 50 см.
Хингидронный электрод можно применять для измерения pH растворов до 8,4
единиц, так как в щелочной среде он не работает. Поэтому в работе мы
использовали стеклянный электрод, так как он более практичен.
Составили цепь:
⊖ Ag, AgCl | Cl- |стекло | H3O+ |Cl- | AgCl, Ag ⊕
Измерили напряжение цепи между стеклянным и хлоридсеребряным электродом сравнения, используя поочерёдно все приготовленные растворы. Измерили температуру рабочего раствора.
По калибровочным данным стеклянного электрода (рис.5) нашли значения pH всех приготовленных растворов (таблица 4).
Рис. 9. Зависимость 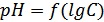
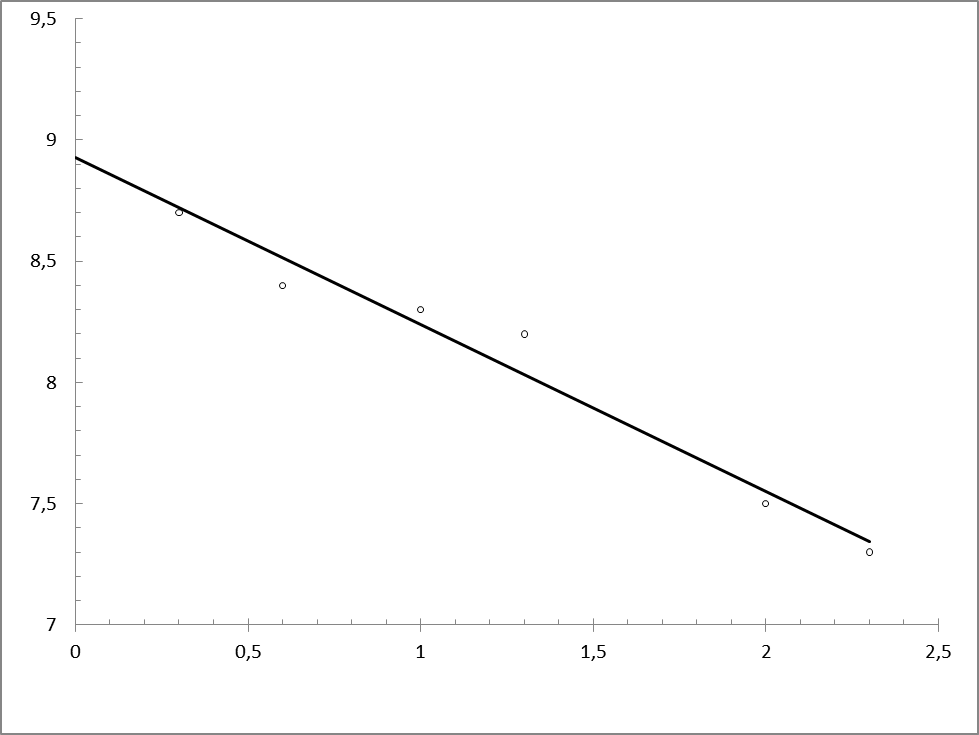
Определили наклон этой зависимости:

Экстраполяцией  -зависимости на
-зависимости на  нашли величину
нашли величину



Вывод: в данной работе мы определи концентрационную константу гидролиза соли потенциометрическим методом –  .
.